Text: Ute Schönfelder
Ein sensorbasiertes Unterstützungssystem für Tumor-Operationen entwickelt ein interdisziplinäres Forschungsteam von Universität und Uniklinikum Jena gemeinsam mit weiteren Projektpartnern. Das 2023 gestartete Projekt »Sensorisierte Chirurgie« wird von der Carl-Zeiss-Stiftung im Programm »Durchbrüche« gefördert. Ziel ist ein System, das Chirurginnen und Chirurgen bei der Tumor-Entfernung assistiert, indem es während der Operation in Echtzeit optische und haptische Rückmeldungen liefert. Neben Teams aus der Informatik und der Medizin sind auch Forschende des Leibniz-Institut für Photonische Technologien sowie der TU Ilmenau beteiligt.
Tumor vollständig entfernen und gesundes Gewebe schonen
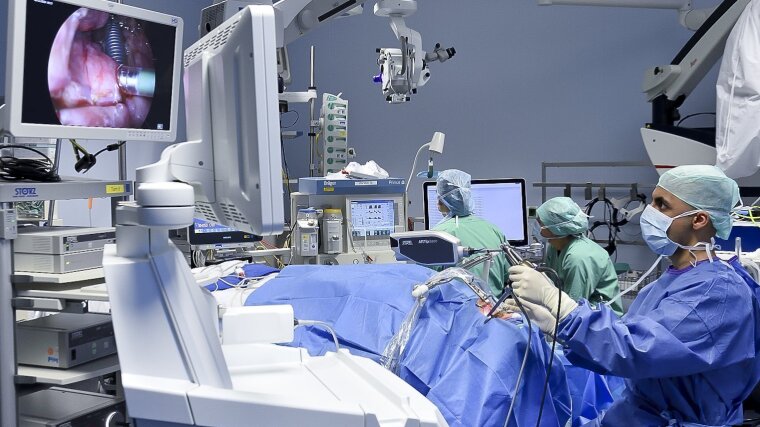
Bösartige Tumoren sind nicht selten lebensbedrohliche Erkrankungen und werden, wenn möglich, operativ entfernt. »Dabei geht es darum, das Tumorgewebe vollständig zu entfernten und zugleich das umliegende gesunde Gewebe zu schonen«, sagt Prof. Dr. Orlando Guntinas-Lichius von der Klinik für HNO-Heilkunde des Jenaer Uniklinikums und Koordinator des Projektteams. Um die Grenze zwischen Tumor und gesundem Gewebe erkennen und präzise schneiden zu können, nutzen Chirurginnen und Chirurgen bislang beispielsweise weißlichtbild-gestützte Videoendoskopie und entscheiden dann anhand ihrer Erfahrung über Tumorgrenzen und Schnittführung.
»Doch in bis zu 30 Prozent der Fälle wird mit diesem Vorgehen der Tumor nur unvollständig entfernt, was die Überlebenschance der Patientin oder des Patienten verringert«, so Guntinas-Lichius. Selbst mit immer präziser arbeitenden OP-Robotern lasse sich dieser Anteil nicht wesentlich verringern, solange sich die Auflösung und Darstellung der Gewebegrenzen nicht ebenso verbessert.
Genau das versucht das interdisziplinäre Team jetzt zu erreichen und eine komplexe sensorisierte Chirurgie zu entwickeln: Mittels neuartiger biophotonischer Bildgebung und biomechanischer Sensorik wollen die Forschenden die Tumorgrenzen während der OP hochaufgelöst und in Echtzeit darstellen und zugleich haptisch vermitteln, so dass die Operierenden den Tumor nicht nur sehen, sondern auch »ertasten« können.
Bei diesem Vorhaben spielt KI eine zentrale Rolle. Grundlage dafür bilden Daten von histopathologischen Untersuchungen von Kopf-Hals- und Hirn-Tumoren, sowohl aus dem Universitätsklinikum Jena als später auch aus einem überregionalen Kliniknetzwerk, mit denen mehrere dezentrale Modelle für Maschinelles Lernen gespeist und trainiert werden. Als Histopathologie werden Untersuchungen von Gewebeproben bezeichnet, die zum Beispiel durch Biopsien gewonnen werden und dazu dienen, bösartige Veränderungen in den Zellen und Geweben zu diagnostizieren.
Die lokalen, an den einzelnen Kliniken genutzten ML-Modelle sollen durch sogenanntes föderales Lernen ein gemeinsames zentrales ML-Modell aufbauen, wobei kritische Anforderungen wie etwa die Datensicherheit gewährleistet bleiben, da sensible Patientendaten die behandelnde Klinik nicht verlassen. »Das globale Modell wird kontinuierlich aus Daten der lokalen Modelle aktualisiert und dabei werden automatisch die stabilen Merkmale, das heißt die kausalen Merkmale für die Aufgabe ermittelt«, so Guntinas-Lichius weiter. Kausale Merkmale werden zum Beispiel spezifische molekulare Eigenschaften der Tumoren sein, die biophotonisch detektiert werden.
Das globale Modell wird anschließend den lokalen Modellen zur Verfügung gestellt und dort an die individuelle Umgebung angepasst. Am Ende des Vorhabens soll ein kontinuierliches föderales Lernsystem vorliegen, das die Ränder jedes individuellen Tumors verlässlich erkennt.