Text: Uta von der Gönna
Am Anfang war das Ei – nein, ganz so einfach ist diese Geschichte nicht zu erzählen. Sie hat mindestens zwei Anfangspunkte. Das Ei – genauer gesagt das Straußenei – kommt erst später ins Spiel.
Zunächst einmal geht es um Patientinnen und Patienten mit Lebererkrankungen. Um ihre Leber untersuchen zu können, braucht es möglichst hochauflösende Bildgebungsverfahren. Normalerweise kommt dabei die dreidimensionale Bildgebung im MRT (Magnetresonanztomographen) zum Einsatz. Wo dies nicht möglich ist, etwa wenn ein Patient oder eine Patientin einen Herzschrittmacher hat oder wegen Nierenproblemen die Kontrastmittel nicht verträgt, bleibt nur die sogenannte Szintigraphie, bei der Leber und Gallengänge mittels radioaktiv markierter Arzneimittel abgebildet werden. Mit den bisherigen radioaktiv markierten Substanzen lässt die Auflösung der dabei entstehenden Bilder allerdings zu wünschen übrig. »Vor allem fehlt die für die Beurteilung der Organfunktion oder die Operationsplanung wichtige exakte dreidimensionale Darstellung«, macht Prof. Dr. Martin Freesmeyer deutlich, Chefarzt der Nuklearmedizin am Universitätsklinikum Jena.
Die neu entwickelte Methode ermöglicht detaillierte dreidimensionale Einblicke in das Straußenei. Links: das Ei im normalen CT, rechts mit PET.
Abbildung: Martin Freesmeyer/UKJNeuartiges Kontrastmittel gesucht
Abhilfe kann ein Bildgebungsverfahren schaffen, das solche räumlich hochaufgelösten dreidimensionalen Bilder erzeugen kann: die Positronenemissionstomographie, kurz PET. In Kombination mit einem Computertomographen (CT) liefert diese Methode eine exakte anatomische Auflösung, so dass die Untersuchung heutzutage standardmäßig als PET/CT durchgeführt wird. Analog zum Kontrastmittel in der Radiologie kommen hierbei mit radioaktiven Isotopen gekoppelte Biomarker zum Einsatz (»Tracer«). Allerdings sind für Untersuchungen der Leberfunktion bislang keine geeigneten Tracer für das PET/CT etabliert. »Die vorhandenen Lebertracer sind nicht spezifisch genug und extrem schwierig in Herstellung und Handling«, so Prof. Freesmeyer. »Wir brauchten also ein besseres Radiodiagnostikum für die Leber-PET/CT.« Gemeinsam mit der Arbeitsgruppe von Prof. Dr. Wolfgang Weigand vom Institut für Anorganische und Analytische Chemie der Universität hat das Forschungsteam die chemische Struktur solcher Lebertracer entworfen, diese anschließend synthetisiert und chemisch charakterisiert.
Radioaktiven Marker zielgenau zur Leber lotsen
Wegen seiner relativ einfachen Handhabung wählte das Forschungsteam das Radionuklid Gallium-68 als radioaktiven Marker. Es lässt sich einfach vor Ort gewinnen und hat eine kurze Halbwertszeit, was die Strahlenexposition für das Gewebe begrenzt. Das Radionuklid alleine findet jedoch noch nicht den Weg in die Leber. Dafür braucht es eine Hülle mit spezifischen Bindungsmolekülen (»Liganden«), die es zielgerichtet in die Leber bringen können. Als solche Liganden kommen fettlösliche Stoffe infrage, deren biologischer Stoffwechsel- und Ausscheidungsweg über die Leberzellen führt. Anhaltspunkte für die Ligandenstruktur lieferte ein bereits etabliertes Kontrastmittel für die Leber, welches als nicht-radioaktive Substanz regelmäßig bei MRT-Untersuchungen zum Einsatz kommt.
»Wir haben die Liganden mit weiteren funktionellen Gruppen ausgestattet, damit das Gallium-Ion hinreichend fest gebunden wird und die Substanz unter physiologischen Bedingungen – also im Blut – stabil bleibt«, beschreibt Dr. Julia Greiser das Vorgehen. Die Chemikerin hat im Rahmen ihrer Dissertation diese Synthesen durchgeführt und forscht jetzt im Bereich Radiopharmazie der Klinik für Nuklearmedizin. Wie in einer chemischen Änderungsschneiderei hat Julia Greiser die Liganden verändert, bis vielversprechende Kandidaten für den Leber-Tracer entstanden sind.
Dabei war auch etwas Glück im Spiel: »Die Synthese läuft nach einem völlig neuen Reaktionstyp und ohne aufwendige Reaktionsbedingungen ab, so dass sich bei der Herstellung gute Ausbeuten erzielen ließen«, so Julia Greiser. Inzwischen sind für die Substanzgruppe und deren Synthese mehrere Patente erteilt.
Neuer Tracer durchläuft Test- und Prüfverfahren
Bevor der neue PET/CT-Tracer jedoch in der Klinik angewendet werden kann, muss das neue Kontrastmittel eine Vielzahl von Tests und Prüfungen bestehen. So wird zunächst geprüft, ob der Tracer tatsächlich leberspezifisch ist, sich also nach der Injektion im Lebergewebe anreichert. Um das zu testen, kommen bislang meist Tierversuche zum Beispiel an Mäusen und Ratten zum Einsatz.
Das hat neben ethischen Aspekten auch den Nachteil, dass dafür teure Forschungsgeräte, nämlich spezielle Kleintier-PET/CT-Systeme erforderlich sind, die in Anschaffung und Betrieb erheblichen finanziellen sowie räumlichen und personellen Aufwand mit sich bringen. Das Forschungsteam suchte daher nach einer Lösung, bei der die vorhandene Technik in der Klinik für Nuklearmedizin genutzt werden kann: Dort werden täglich viele Patientenuntersuchungen an einem – im Vergleich zum Kleintier-PET/CT – deutlich größeren PET/CT-System durchgeführt. »Zudem ist uns wichtig, nur im wirklich notwendigen Maß Tierversuche durchzuführen und diese, wo immer es möglich ist, durch Alternativen zu ersetzen«, betont Prof. Freesmeyer.
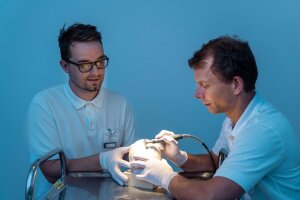
Dr. Thomas Winkens (r.) und Medizinphysiker Christian Kühnel präparieren ein bebrütetes Straußenei. Ein Teil der Kalkschale wird entfernt, um die Kanüle mit der radioaktiv markierten Tracersubstanz injizieren zu können.
Foto: Anna Schroll/UKJAlternative zum klassischen Tierversuch
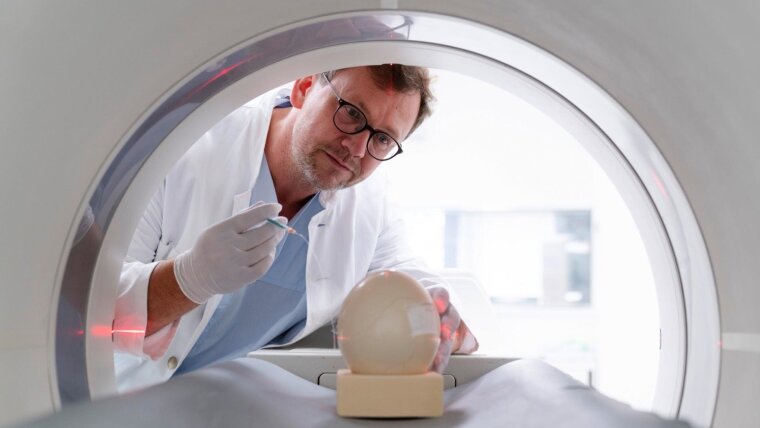
Und da kommt nun der andere Ansatzpunkt dieser Forschungsgeschichte ins Spiel: In Analogie zum bebrüteten Hühnerei, das zum Beispiel in der Impfstoffforschung bereits lange etabliert ist und keinen klassischen Tierversuch darstellt, übertrugen die Wissenschaftler das Konzept der Verwendung bebrüteter Eier auf die Bildgebung und wählten dafür das größte verfügbare Ei – das des Straußes. Es misst etwa 15 Zentimeter im Durchmesser und ist hinreichend groß für das klinische PET/CT-Gerät.
Mit der Bildgebung am bebrüteten Straußenei betrat das Forschungsteam allerdings völliges Neuland. »Nach 25 Tagen im Brutschrank markieren wir auf der Schale die im Durchlicht sichtbaren Eihautgefäße. Kurz vor der Untersuchung, nach einer Brutzeit von 34 bis 37 Tagen, entfernen wir dort vorsichtig einen Teil des verkalkten Teils der Eischale, ohne die darunterliegende Eihaut mit ihren Gefäßen zu beschädigen. Mit sehr dünnen Kanülen, wie sie auch in der Neonatologie eingesetzt werden, injizieren wir dann den Radiotracer«, beschreibt der Nuklearmediziner Dr. Thomas Winkens die eigens entwickelte Methodik. Auf diese Weise gelangen den Wissenschaftlern bereits eindrucksvolle Bilder des Vogelembryos – und der Nachweis, dass der neue Radiotracer hochspezifisch für die Leber ist. Im Rahmen eines von der Deutschen Forschungsgemeinschaft geförderten Projekts wird das Team das Straußenei-Modell in den kommenden Jahren weiterentwickeln und als Alternative zum klassischen Tierversuch etablieren.
Vorbereitungen für Patienten-Anwendungen werden getroffen
Damit der neue Lebertracer irgendwann tatsächlich auch in der Patientenversorgung zum Einsatz kommen kann, werden derzeit noch Toxizitätstests durchgeführt. Diese sollten jedoch kein Problem sein, schließlich seien die eingesetzten Mengen der molekularen Radiotracer so gering, dass sie im »subpharmakologischen« Bereich liegen, also keine schädliche Wirkung zu erwarten ist, sagt Prof. Freesmeyer.
Bei der Herstellung der Tracer, für die das Radioisotop erst kurz vor der Untersuchung erzeugt und mit den Liganden zur Reaktion gebracht wird, sind höchste Reinheit und Exaktheit erforderlich. »Wir arbeiten derzeit daran, für die Synthese der Liganden die Qualitätsrichtlinien der Arzneimittelproduktion umzusetzen«, erklärt Julia Greiser. Damit erfüllt das Team wichtige Voraussetzungen, um die neuen Tracer bald auch an Patienten einsetzen und testen zu können.
Laufendes Projekt:
In-Ovo-Bildgebung embryonierter Eier großer Laufvögel – Evaluierung einer Alternative zum klassischen Tierversuch (Deutsche Forschungsgemeinschaft)
07747 Jena Google Maps – LageplanExterner Link